FDA对医疗器械有3种监管分类:I类,II类和III类。分类是根据医疗设备给患者带来的风险以及FDA确定的合法销售设备所需的监管水平来分配的。随着分类级别的提高,对患者和FDA法规控制的风险也随之增加。如果你的产品想出口美国,必须要进行FDA认证。下面医疗器械如何进行FDA注册呢?有没有流程图类的东西作参考?

医疗器械FDA认证介绍
医疗器械的FDA认证包括:厂家在FDA注册、产品的FDA登记、产品上市登记(510表登记)、产品上市审核批准(PMA审核) 。医疗保健器械的标签与技术改造、通关、登记、上市前报告须提交以下材料:
(1)包装完整的产成品五份
(2)器械构造图及其文字说明
(3)器械的性能及工作原理
(4)器械的安全性论证或试验材料
(5)制造工艺简介
(6)临床试验总结
(7)产品说明书
FDA对医疗器械的提交要求
如果您的产品属于I类类别,则您很可能不必获得FDA的批准或批准。但是,您仍必须满足FDA I类产品注册要求。
如果您的产品属于II类类别,则您很可能需要准备510(k)提交材料才能满足FDA设备注册要求。根据设备的性质,您的FDA 510(k)申报文件可能包含或不一定包含临床数据。
如果您的产品是III类设备,则FDA提交的内容包括Pre-Sub(Pre-IDE)和IDE咨询。
医疗器械FDA认证流程图
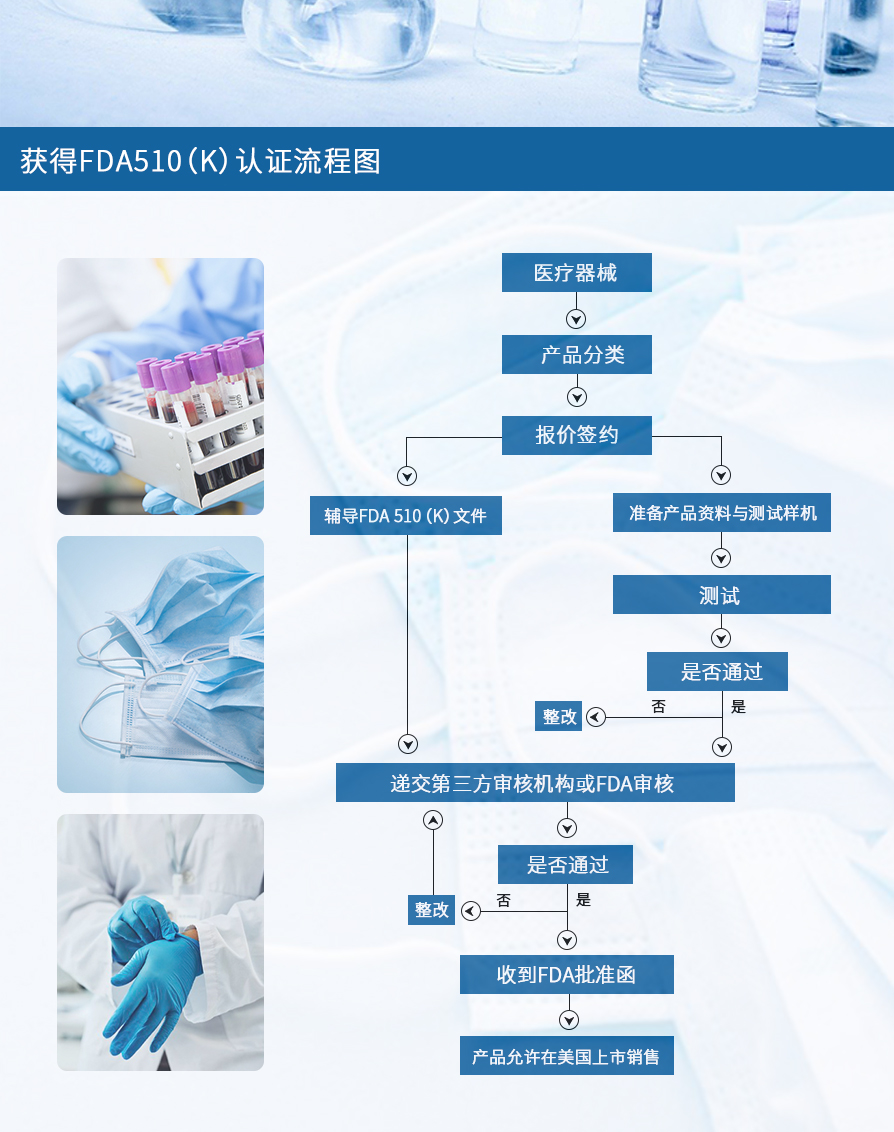
以上就是关于“医疗器械FDA认证流程图”的相关内容,了解更多点击咨询。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为FDA认证提供一站式服务,咨询电话:400-106-2206。














