在FDA进行注册后,有些产品是需要验厂的。所谓验厂就是指FDA会派人员过来对工厂进行审核,如果审核不达标,那你生产的产品就不能在美国销售,即使已经进行了FDA注册也不要以。所以很多企业会在FDA验厂前进行咨询,以后了解其验厂的流程和相关内容,从而提高验厂成功的机率。

FDA验厂咨询步骤
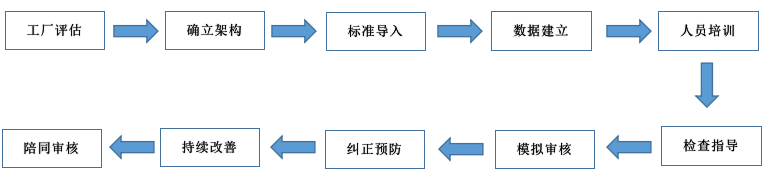
1. 首先做好提前准备检查接待,建立一个检查应对管理小组,内部审计项目,模拟检查项目。
2. 检查时间及人员安排,通常来说一类二类器械均为1名检察官;三类器械为1名或2名检察官,4-5个工作日。
3. 评审文件:FDA检察官到现场,首先会评审文件,按QSIT方法--基于7个子系统4个主要子系统(管理、设计、纠正预防、生产过程);3个支持子系统(文件、物料、生产工具和设备控制);FDA检查工作时会以点带面,抓住一点,可在一个问题上几个来回,也可能检查整个公司的质量管理体系。
4. 现场检查,注意检察官都特别警觉,能从周围环境中获取信息,融合信息进行判断。他们会阅读看到的文件包括公告,桌面上的文件等。有时候这些里面含有未被批准或者未被记载的章程,不受控的安全事宜,比如密码。确保员工有这种意识,随意流露出的信息不应该给检察官造成误导,文件不受控或者不安全,检察官在的地方不应该有多余文件。
5. 检查结束前会有末次会议。末次会议最好有公司高层参加以表明公司对合规性的重视。
末次会议期间检察官会提供FDA-483表格,里面有缺陷列表。检查483表格,如果有含糊的问题请跟检察官澄清,记录所有检察官对问题的答复。如果有明显的误解,请友好指出并提供证据。在医疗器械检查中公司可以选择是否对483表格注解。
检查结果无非有:
- 没有483表格
- 483表格只含有微小缺陷,无不符合性历史和警告信
- 483表格有重大缺陷和警告性
- 438表格有重大缺陷,鉴于之前的不符合性和警告性会导致更严重的法律制裁
- 法律制裁有:禁令,扣押,罚金和进口滞留。
给483表格书面答复很重要般15天内答复。(虽然15天答复不是强制要求,是一般规律)请确保完整全面答复,答复中应包含纠正措施的书面证据。
6. 我们提供验厂辅导服务包含:
- 现已有质量管理体系与法规要求的差距;
- 咨询过程的整体设计,包括现场的整改以及文件化体系以及应用的整改;
- 基于FDA审核要求文件记录审阅、检查生产全过程GMP/QSR820等体系建立与维持;
- 咨询师与企业相关人员一起进行文件系统修整;
- 帮助企业发现车间和仓库的不足与整改;
- 对企业人员进行迎接审核技巧的培训;
- 体系有效性的检查,在FDA来审核之前,安排本公司评审员进行模拟审核;
- 陪同FDA验厂、担当翻译;
- 协助企业进行不符合项的整改;
- 确保顺利通过FDA验厂。
注意事项
拒绝FDA验厂,后果很严重,可能会导致制造商丢掉原有的大片美国市场,造成很大的损失。FDA审查官发现了工厂的管理系统有违背FDA的质量体系法规的内容,进而开具了书面形式的不符合项,也可以开具了“483”表。只要工厂按照FDA的要求积极整改,提供充分的证据都不会导致更多后果。
以上就是关于FDA验厂咨询的内容,了解更多点击咨询。














