EN 1041:2008 是医疗器械制造商提供的信息的统一标准。
国际标准化组织 (ISO) 最近发布了 ISO 20417:2021,它将取代关于医疗器械和体外诊断医疗器械(MDR 和 IVDR)的法规 (EU) 2017/745 和 2017/746 下的 EN 1041。 这意味着医疗器械制造商应该熟悉 ISO 20417 并立即开始应用。
本文将为您提供该标准的概述,并将了解它与 EN 1041 之间最重要的区别。
1. ISO 20417的范围
a) ISO 20417 考虑的法规
该标准在介绍中指出,其目标是作为普遍适用的信息要求的中心来源。为此,它考虑了以下法规中规定的对所提供信息的要求:
- IMDRF/GRRP WG/N47:2018 医疗器械和 IVD 医疗器械安全和性能的基本原则
- IMDRF/GRRP WG/N52:2019 医疗器械和 IVD 医疗器械标签原则关于医疗器械制造商提供的信息
- MDR(欧盟)2017/745
- IVDR(欧盟)2017/746
b) ISO 20417 提供的信息
ISO 20417 一开始就明确了它想要提供规范的信息类型。它还提供了一些重要的术语定义。
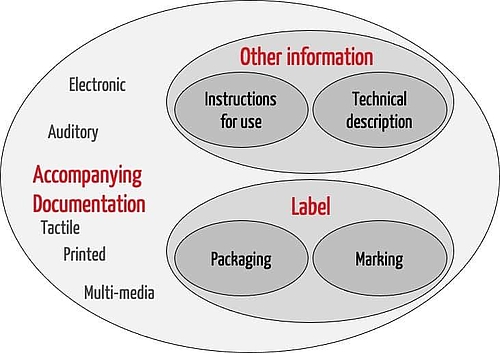
图 1:ISO 20417:2021 的范围
ISO 20417 适用于随附信息。这包括标签和其他信息。标签依次由包装上的信息和设备本身的标记组成。“其他信息”包括使用说明和技术说明。
2. ISO 20417 与 EN 1041 的差异
EN 1041 的第 4 节“要求”在 ISO 20417 中分为两个部分(现在包含更多的要求):
- 4 “一般考虑”
- 5 “要建立的信息要素”
EN 1041 的第 5 节“信息提供要求”已整合到 ISO 20417 的第 6 节“随附信息的要求”中。它现在有以下子部分:
- 6.1 “标签上提供信息的要求”
- 6.2《医疗器械或附件可拆卸部件标识要求》
- 6.5 “包装上的信息”
- 6.6 《使用说明书和技术说明中的信息要求》
部分
- 6.3 “标签的易读性”(EN 1041 中的“易读性”)和
- 6.4 “标记的耐久性”(EN 1041 中的“可用性”)
在 ISO 20417 中已经与 EN 1041 相似,但范围有所增加。
EN 1041 中的第 5.2.2 节“可访问性”现在位于 ISO 20417 的第 4(e) 节中,第 5.2.5 节“安全性”已被省略。与 EN 1041 不同,ISO 20417 没有明确要求保护标签免受损坏和故意修改。
EN 1041 的第 5.2.6 节“提供的信息的更改”也不包含在 ISO 20417 中。根据 ISO 20417,现在提供的信息的更改不一定必须报告给现有用户。第 6 节“文档”已也被省略了。
3. 总结
ISO 20417以清晰易懂的方式总结了各种相关法规的要求。它澄清了 MDR/IVDR 中一些不太明确的要求,并就如何遵守这些要求给出了实际指导,使制造商更容易高效地满足 MDR/IVDR 和其他法规的要求。
术语有明确的定义和区分,这应该有助于防止混淆,例如术语label和labeling之间的混淆,并确保对术语的共同理解。
ISO 20417 为制造商提供了有关如何满足随附信息要求的真正指导。
建议制造商使用 ISO 20417审查其随附信息,如果有,则更新其随附信息(标签)清单。














