2020年新冠肺炎在全球范围爆发,导致数以万计条生命受疫情影响而伤亡,因此口罩在大多数国家供不应求。下面就为大家详细介绍一下在欧洲医用外科口罩ce认证标准及要求,还在等什么?快来了解一下吧!

1. 医用外科口罩的要求
根据新医疗器械法规(MDR)Chapter I 中Article2对于医疗器械的定义,医用外科口罩属于医疗器械,应符合新医疗器械法规(MDR)的相关要求。2017年5月5日,欧盟官方期刊(Official Journal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类医疗器械指令)and 93/42/EEC(医疗器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
2. 医用外科口罩CE认证标准
根据医疗器械法规(MDR)的Chapter V中Article 41对于医疗器械的分类,医用外科口罩分非无菌医用外科口罩和无菌医用外科口罩。非无菌医用外科口罩属于I类医疗器械,其测试标准为EN14683,无菌医用外科口罩属于Is类医疗器械,测试标准为EN14683+灭菌标准。
3. 医用外科口罩的符合性评级
除定制或调查设备外,被分类为I类设备的制造商,应在草拟附件2中列出的技术文件后,通过发布第17条所指的欧盟符合性声明宣布其产品的合格性。如果器械以无菌状态投放市场,是可重复使用的手术器械或具有测量功能,制造商应采用附件8第一章(质量管理体系)和第三章(管理规定)或附件a部分中规定的程序十。但是,被通知机构的参与应限于:
- 对于处于无菌状态投放市场的设备,涉及到建立、保护和保持无菌条件的相关方面;
- 具有计量功能的装置的,应当符合计量要求的有关方面;
- 在可重复使用外科器械的情况下,涉及到器械的重复使用,特别是清洗、消毒、灭菌、维护和功能测试以及相关使用说明。
4. 医用外科口罩的技术文件
技术文件以及在适用的情况下制造商编写的摘要应以明确、有组织、易于检索和明确无误的方式提出,并应特别包括下列要素:本附件2所述。
- 设备描述和规范,包括变种和附件
- 制造商提供的信息
- 设计和制造信息
- 一般安全和性能要求
- 风险/效益分析和风险管理
- 产品验证和验证
- 关于上市后监测的技术文件
- 欧盟符合性声明
5. 医用外科口罩的符合性评估程序流程图
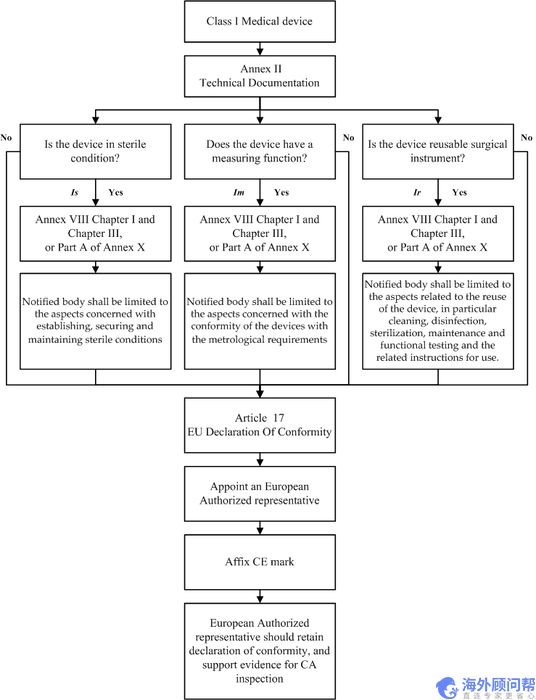
从上述要求来看,对于无菌医用外科口罩,如果目前还没有获得公告机构(Notified Body)的审核,临时去申请CE认证已经没有任何可能性。因此目前出口到欧洲的医用外科口罩产品应该只有非无菌医用外科口罩这一个选项。
以上就是关于“医用外科口罩ce认证标准”的相关内容,了解更多请咨询【海外顾问帮】。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为CE认证提供一站式服务,咨询电话: 400-106-2206。














