UDI是什么?
UDI是对欧洲医疗器械(MDR)和IVD(IVDR)法规进行全面修订的一小部分。
欧洲UDI系统在整个欧洲实施IMDRF UDI指南
- MDR第27条
- IVDR第24条
1. MDR中的UDI
第三章–设备的识别和可追溯性
- 第27条-UDI系统
- 第28条-UDI数据库
- 附件六:
- B部分–要输入数据库的核心元素
- C部分–系统的定义和详细信息
2. UDI –主要要求
附件VI C部分中所述的唯一设备标识系统(“ UDI系统”)应允许标识并促进除定制设备和研究设备以外的设备的可追溯性,并且该设备应包括以下内容:
(a)生产包括以下内容的UDI:
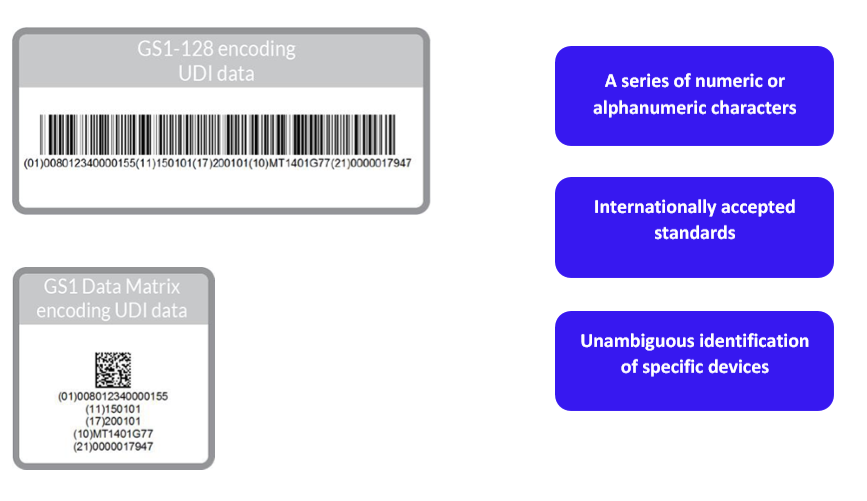
- 特定于制造商和设备的UDI设备标识符(“UDI-DI”)。UDI-DI是一种特定于设备模型的唯一数字或字母数字代码,它还用作对存储在UDI数据库中的信息的“访问密钥”。
- UDI生产标识符(“UDI-PI”),用于标识设备生产单位以及包装设备(如适用)。UDI-PI是一种数字或字母数字代码,用于标识设备生产单位。不同类型的UDI PIs包括序列号、批号、软件标识和制造或到期日期或两种日期类型。
(b)将UDI放置在设备的标签或其包装上;
(c)经济经营者,卫生机构和家庭护理专业人员存储UDI;
(d)建立用于唯一设备识别的电子系统(“ UDI数据库”)。
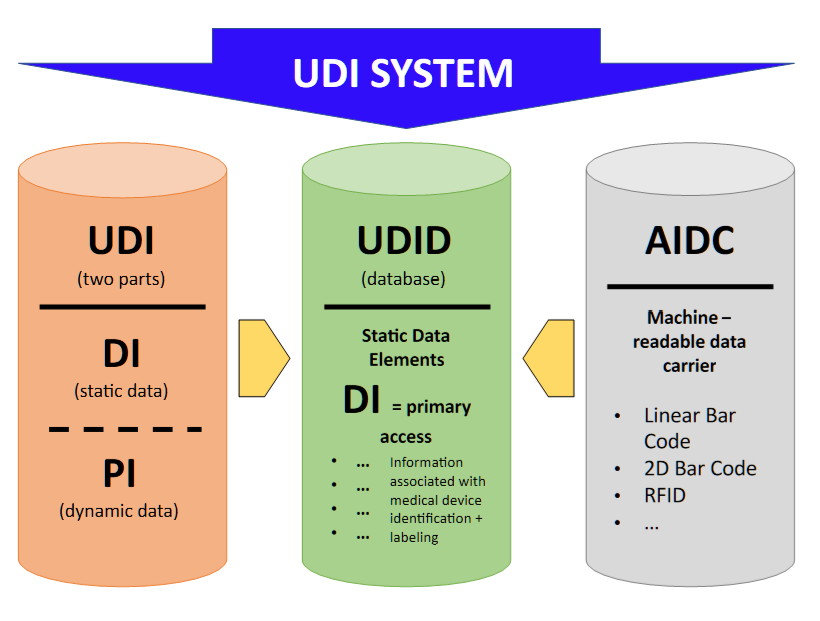
DI =设备标识符
PI =生产标识符
3. UDI发行实体
- 欧盟委员会应通过实施UDI签发实体的行为来指定,前提是它们满足某些条件
- 这些标准包括:
- 用于分配UDI的实体系统足以根据《规章》的要求通过其分配和使用来识别一种设备;
- 分配UDI的实体系统符合相关国际标准;
- 实体根据一组预定且透明的条款和条件访问其系统,以将UDI分配给所有感兴趣的用户。
- 在委员会指定UDI签发实体之前,应将GS1,HIBCC,ICCBBA视为指定签发实体。
4. UDI数据/ UDI载体的分配/提交
- 在将设备投放市场之前,制造商应分配给该设备,并在适用的情况下分配给所有更高级别的UDI包装。
- UDI载体应放在设备的标签上以及所有更高级别的包装上。较高级别的包装不包括运输容器。
- 在将设备投放市场之前,制造商应确保已将有关设备的附件V B部分中提到的信息正确提交并转移到UDI数据库中。
- 在某些情况下,要求制造商在申请合格评定之前为设备分配基本UDI-DI(认证机构将在证书中包括对BASIC UDI-DI的引用)。
5. 基本UDI-DI的主要功能
- UDI数据库中记录的主键
- 符合性声明
- 安全通讯(FSN)
- 技术文档
- 安全性和临床表现摘要
- 公告机构颁发的设备认证
- 免费销售证明书
6. 主要截止日期
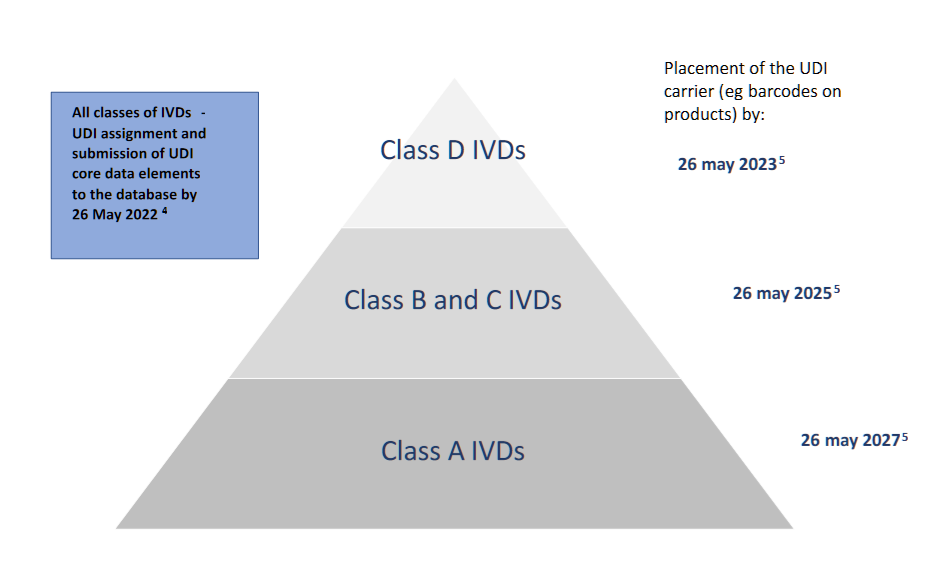
- UDI的分配和UDI核心数据元素向数据库的提交:新法规的应用日期(除非EUDAMED在该日期之前无法运行)。
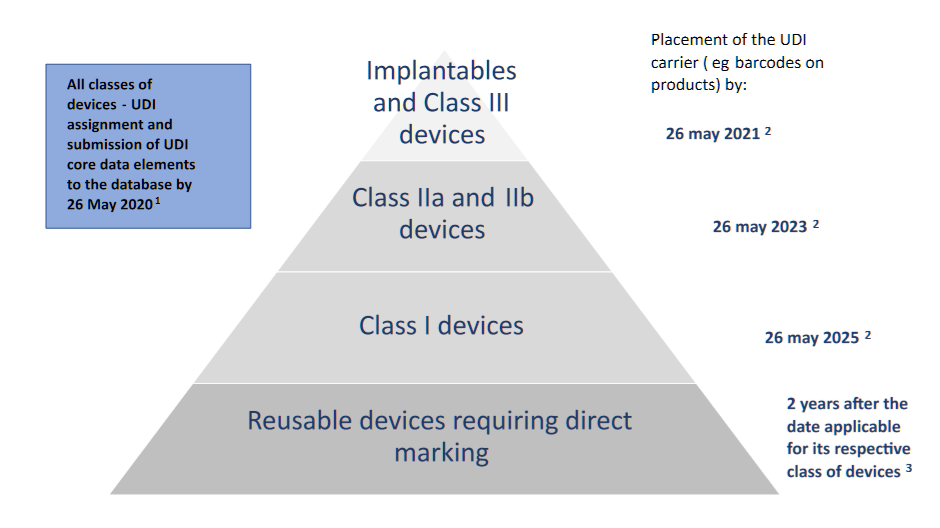
- UDI承运人的位置:
- 可植入设备和III类设备(和D类IVD):自申请之日起1年。
- IIa类和IIb类设备(C类和B类IVD):自申请之日起三年;
- I类设备(A类IVD):自申请之日起5年;
- 应在设备本身上带有UDI载体的可重复使用设备:在适用于其各自设备类别的日期后两年。
7. 其他重要方面
- 制造商,进口商,分销商对UDI的法律责任
- UDI数据元素:EU UDI数据库中的医疗设备术语
- UDI-PI组件:仅当制造日期是标签上显示的唯一生产标识符时,才包括制造日期
- 在某些可预见的条件下需要新的UDI-DI
- 如果标签上有空间限制,则应首选AIDC 格式,除非打算在卫生机构(HRI)之外使用设备
- 在设备上直接标记可重复使用的设备,但有一些豁免
- 没有预见的临时豁免
- 植入式设备,系统和程序包,可配置设备,设备软件的特定规则
8. UDI提高安全性
使用基于国际指南的唯一设备识别(UDI)系统应通过以下方式显着增强医疗设备的上市后安全性:
- 改善事件报告
- 改善安全纠正措施
- 更好地定位召回
- 主管当局进行更好的监测
- 减少医疗错误
- 打击假冒设备
- 改善医院的采购政策和库存管理
9. 欧洲UDI时间线
1)(EU)2017/745号法规– 2017年5月5日–第123条第2款
2)(EU)2017/745号法规-2017年5月5日–第123条第3(f)款
3)(EU)2017/745号法规– 2017年5月5日–第123条,第3(g)款
4)(EU)2017/746法规– 2017年5月5日–第113条,第2款
5)(EU)2017/746法规– 2017年5月5日–第113条,第3(e)款
以上就是关于“ 什么是UDI(唯一设备标识)?”的相关内容,了解更多点击咨询。















