FDA对OTC非处方药品的要求以及法规是什么?相信做美国出口的药品企业都想知道。如果你看到这篇文章,那么恭喜你,你的问题不仅解决了,而且还有专门的技术顾问帮你解答更专业的知识。好了,我们快来看看具体内容吧。

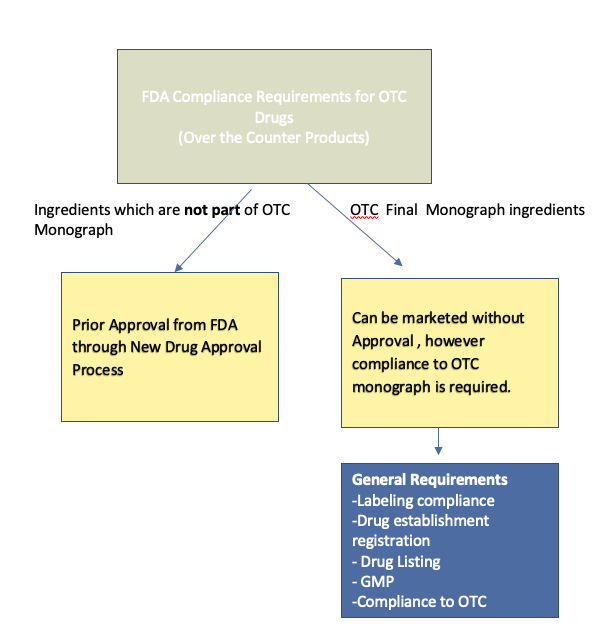
FDA对OTC的要求因非处方药专著产品和新的非处方药而异。
含有OTC最终专著中公布的活性成分的药物,可在未经FDA事先批准的情况下上市。
但是,如果您打算以非OTC专论的一部分销售具有有效成分的OTC药物,则应通过新药批准程序获得FDA批准。
《美国联邦法规》第21卷第330部分列出了非处方药的专著成分以及FDA对非处方药的规定。
FDA对OTC非处方药品的要求
- 符合OTC专论:成分、浓度和用途应符合OTC专论。
- OTC药品标签:标签的内容和格式应符合FDA OTC药品标签要求。
- 企业注册:涉及制造,包装,加工或药品的制造设施必须在FDA注册。
- NDC药品清单:药品清单是在美国销售的所有药品的强制性要求。
- GMP(良好制造规范):产品的制造应符合21 CFR 210和211中定义的良好制造规范。
- 美国代理任命:外国机构必须指定美国代理,以进行FDA沟通。
OTC防晒产品必须符合FDA指南中关于未经FDA批准销售的OTC防晒产品的附加要求。
非处方药生产商亦须于每年10月1日至12月31日期间更新其药厂注册。另外,国家数据中心药品上市信息应每年更新一次,如果药品上市信息没有变化的公司必须提交无变化通知。如需有关注册续展流程的更多信息,请点击咨询。
在开发OTC专著药物时,您必须考虑FDA关于OTC药物的规定,即21 CFR第330部分。
海外顾问帮是一家经验丰富的FDA咨询公司,帮助公司遵守FDA对OTC专著药物的要求。














