2021年3月26日,美国食品和药物管理局(FDA)公布了新的2021财年非处方药(OTC)专论企业年费。从今年开始,FDA将要求涵盖的OTC药品企业根据OTC专论用户费用计划(OMUFA)支付年度设施费,该计划是根据2020年3月通过的《关怀法案》建立的。

FDA表示,2021财年的设施费应在当局在《联邦公报》公布2021财年费用标准后45天(2021年5月10日)内缴纳。
这取代了FDA于2020年12月发布的公告。
谁需要缴纳OMUFA设施费?
FDA现在要求生产或加工OTC专论药物成品剂型的企业支付年度专论药品设施(MDF)费用。2021财年的MDF费用为20,322美元。OTC合同生产机构(CMOs)是指OTC药品生产机构,其所有者或其附属机构均不直接向美国的零售商、批发商或消费者销售OTC药品。CMO需要支付常规MDF费用的三分之二。2021财年的CMO费用为13,548美元。
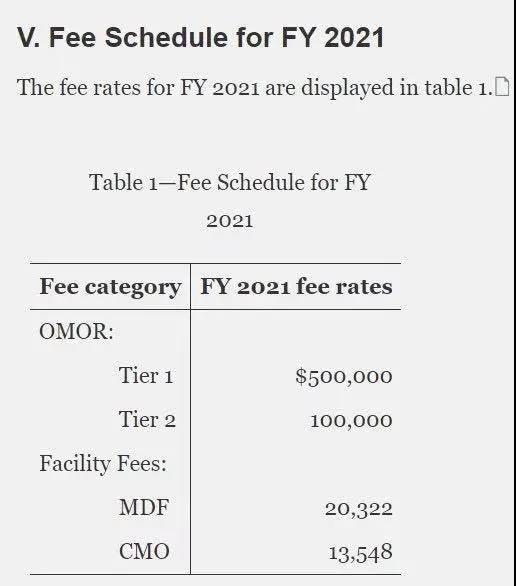
FDA希望向在2020年1月1日至12月31日期间FDA注册或更新其FDA注册的MDFs和CMOs收取这些费用。在2021年1月1日或之后首次在FDA注册的企业不需要支付2021财年OMUFA费用,但在其公布(2022财年的费用)后,这些企业将需要支付2022财年的费用。
FDA本次通知的费用较其去年12月份公布的费用要高。其在2020年12月份公布的收费标准为:MDFs为14,060美元,CMOs 9,373美元。费用标准是根据支持OTC专论药品相关活动所需的预估经费,以及预计缴纳年费的企业数量来制定的。
根据3月的新公告,“FDA将不会对在2020年1月27日新冠肺炎公共卫生紧急情况(PHE)宣布后首次在FDA注册,并且在PHE期间只生产OTC洗手液产品的公司征收OMUFA设施费用。”在一封致行业的邮件中,FDA表示:“由于某些洗手液生厂商将无需缴纳费用,因此,其余需要缴纳年费的企业将会需要支付更高的年费,因为需要缴纳OMUFA费用的企业数量减少了。”

# 不适用于:
OMUFA费用不适用于仅生产活性药物成分(api)、生产临床研究用品、进行测试或在已包装的产品上放置外包装以供试剂盒使用的企业。同样,如果药品企业的注册表明其已在2019年12月31日之前停止所有与OTC专论药物有关的活动,那么其也无需缴纳费用。














