为了提高患者安全性,使设备售后监控现代化并鼓励医疗设备创新,美国食品药品管理局(FDA)制定了“唯一设备标识符(UDI)”标签政策。此策略要求设备标签商将唯一的设备标识符(UDI)包含在设备标签和包装上。那么,美国FDA对UDI贴标要求是什么呢?我们一起来看下。

医疗器械标签要求
世界上大多数行业都有严格的标签标准和规定,但是几乎没有地方比医学行业更仔细地检查标签的细节了。用于促进患者治疗和护理的每台设备都需要带有标签。与规定标准的最小偏差会导致严厉的处罚。
下表概述了UDI最终规则中的关键合规日期。
| 合规日期 | 要求 |
最终规则发布后一年(2014年9月24日) |
III类医疗设备的标签和包装以及根据《公共卫生服务法》(PHS Act)许可的设备必须带有UDI。第801.20条。 这些设备标签上的日期必须按照§801.18的要求进行格式化。这些设备的数据必须提交到GUDID数据库。§830.300。 §801.55可能要求将此合规日期延长1年;此类请求必须在2014年6月23日之前提交III类独立软件必须按照801.50(b)节的要求提供其UDI。 |
| 最终规则发布后的2年(2015年9月24日) |
可植入、生命支持和生命维持装置的标签和包装必须带有UDI。§ 801.20.这些设备标签上的日期必须按照§ 801.18. |
| 如果设备打算多次使用并需要重新处理,则是需要使用UDI进行标记的,作为生命支持或生命维持设备的设备,必须在其自身上带有UDI作为永久标记。每次使用之前。§801.45。 作为生命支持或生命维持设备的独立软件必须按照§801.50(b)的要求提供其UDI。 |
|
| 必须将带有UDI标签的可植入,维持生命和维持生命的设备的数据提交给GUDID数据库。§830.300。 | |
| 最终规则发布后三年(2016年9月24日) | 如果设备是打算多次使用并在每次使用前需要重新处理的设备,则需要用UDI标记的III类设备必须在设备本身上带有UDI作为永久性标记。§801.45。 |
| II类医疗设备的标签和包装必须带有UDI。第801.20条。 这些设备标签上的日期必须按照§801.18的要求进行格式化。 II类独立软件必须提供§801.50(b)要求的UDI。 |
|
| 必须用UDI标记的II类设备的数据必须提交到GUDID数据库。§830.300。 | |
| 最终规则发布后的5年(2018年9月24日) |
如果设备是打算多次使用且打算在每次使用前进行重新处理的设备,则需要用UDI标记的II类设备必须在其自身上带有UDI作为永久性标记。§801.45。 |
| I类医疗设备的标签和包装以及未分类为I类,II类或III类的设备必须带有UDI。第801.20条。所有设备(包括不属于UDI标签要求的设备) 标签上的日期必须按照§801.18的要求进行格式化。 |
|
| 必须将必须使用UDI标记的I类设备和尚未分类为I类,II类或III类的设备的数据提交到GUDID数据库。§830.300。 I类独立软件必须按§801.50(b)的要求提供其UDI。 |
|
| 最终规则发布后的7年(2020年9月24日) | 如果设备是预期使用的设备,则I类设备以及未分类为I,II类或III类且需要用UDI标记的设备,必须在设备本身上带有UDI作为永久标记。可以多次使用,并打算在每次使用之前进行重新处理。§801.45。 |
| 最终规则所有其他规定的遵守日期。 除上述规定外,FDA要求从适用于该规定的生效日期起完全遵守最终规则。 | |
UDI标签的剖析
UDI是由设备标识符(DI)和生产标识符(PI)组成的唯一数字或字母数字代码,所有UDI均应在由FDA认可的发行机构操作的系统下发行。
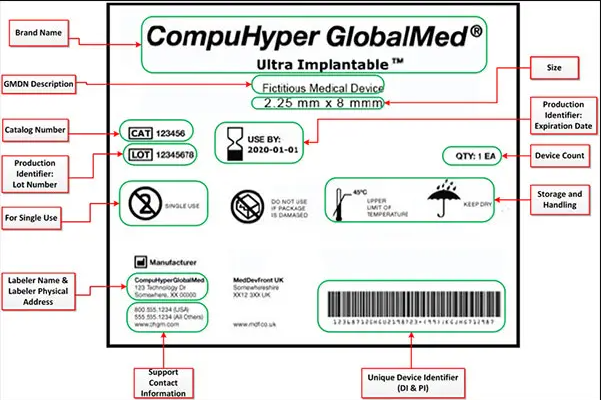
唯一设备标识符(UDI)规则和规定
- DI是必填项,用于标识标签和设备模型的特定版本.
- PI是UDI的可变部分,可以包括制造设备时的批号或批次号,设备的序列号,设备的到期日期和设备的制造日期。
- UDI标签应该是人和计算机都可读的.
- 设备制造商将负责为设备标记UDI标签,标签创建者或协助者有责任将设备信息上传到全球唯一设备标识数据库(GUDID),以使医疗保健相关方可以不受限制地访问。
- UDI标签支持的GUDID将使医生能够下载设备使用说明和指南,并充分利用其特征和功能,以实现最佳的患者护理。
量身定制的标签产品如何在UDI标签革命中发挥作用?
量身定制的标签产品多年来一直是标签世界中的黄金标准。准确,能够承受恶劣的环境条件,并且始终清晰,充满活力和耐用。我们的产品已用于医疗行业的小瓶,设备和容器。我们的能力和技术专长使我们能够通过打印具有正确应用结构的标签和正确包含UDI所需信息的标签,来满足UDI规则和法规。
以上就是关于“美国FDA对UDI贴标要求,FDA关于UDI的新标准”的相关内容,了解更多点击咨询。















