什么是紧急使用授权EUA?
紧急使用授权EUA计划成立于2004年,为了包括该规定(HHS,2010a),《生物盾牌法》等措施修订了《联邦食品,药品和化妆品法》第564条。EUA允许FDA专员在紧急情况下宣布授权使用未经批准的医疗产品或未经批准的使用经过批准的医疗产品,涉及对公共或美国军队的攻击风险增加,或有可能影响国家安全的重大潜力(FDA,2007)。

美国食品药品监督管理局(FDA)在今年(2020年)2月初为了应对各类医疗器械的紧缺发布了各类EUA(紧急使用授权),随后在今年的3月2日及27日又发行了个人防护设备的EUA。包括:
- 呼吸机EUA
- 个人防护设备EUA
- 体外诊断EUA
1. 发布时间及适用产品
| 时间 |
适用产品 |
| 2020年3月2日发行,3月27日重新发行 | 经NIOSH批准的一次性过滤式口罩呼吸器,用于COVID-19公共卫生紧急事件响应期间的医疗保健环境 |
| 2020年3月24日 | 未经NIOSH批准的进口一次性过滤式口罩呼吸哭 |
2. 注意事项
EUA授权的口罩均不能用于个人,只有是医护人员

EUA和FDA认证的区别
EUA由FDA签发,因此反映了FDA通过确保人兽药,生物制品,医疗器械,国家食品,化妆品和其他产品的安全性,有效性和安全性来保护公众健康的使命。发出辐射。FDA负责与反恐和新出现的威胁有关的以下领域:
- 促进制定和提供医疗对策;
- 保护受管制医疗产品的安全和保障;
- 增强应急准备和响应能力;
- 实施全面的粮食安全战略;
- 确保代理机构资产的安全性。
最重要的是,FDA负责通过确保药物,生物制品和设备的安全性,有效性和安全性来保护公众健康。呼吸器和个人防护设备包括在这一广泛的范围内。
作为一般规则,必须通过医学对策来满足健康需求,这些对策应得到良好科学的支持并遵循法规要求。在非紧急情况下,FDA和州法律要求制定明确的标签法律以及处方和使用指南,以保护公众。在紧急情况下,FDA会考虑EUA可能带来的潜在利益,同时绝不放弃其确保使用的医疗对策的安全性,有效性和安全性的基本使命。

办理EUA相当于受到FDA严密的监管,企业要承诺符合以下条件,以便随时接受FDA调查。
- 厂商必须提供EUA授权的型号的用途,使用方法,和其他说明(如适合性测试等)。
- 厂商要提供一封英文信函分发给各类终端用户(比如说医院),这封信函必须包括授权口罩的制造商、型号、预期用途、制造商网页等。
- 厂商必须通知进口商本EUA的条款和条件,并确保接收授权口罩的终用户设施(如各医院等)收到条件B要求的信息。
- 授权厂商要建立一个报告不良事件的程序,并将这些报告发送给FDA.Te1_l82ll30l23l 荆先生。
- 所有描述性印刷材料应与COVID-19爆发期间使用的适用CDC建议以及本EUA中规定的术语一致。(也就是说不能宣传与本产品实质情况不符合的防护能力)
- 任何与在美国使用授权口罩有关的描述性印刷品均不得表达或暗示该产品对预防COVID-19是安全或有效的。
- 授权口罩的厂商将确保与本EUA相关的任何记录得到保存,直到FDA另行通知。根据要求,这些记录将提供给FDA检查。
EUA申请流程
1. 递交申请(附相关资料)
2. FDA根据产品类型提交需要注册的资料清单
3. 企业按要求递交相关资料
4. FDA对其进行审批
5. 企业根据要求进行整改
6. FDA最终做出决定
EUA申请资料
EUA申请的范围是中国生产的一次性防护口罩,立体型。医用平面口罩不在范围内。针对疫情:KN95口罩美国EUA申请资料
1. 厂家的营业执照
2. 产品的型号、标签(英文)
3. 有CNAS盖章的GB2626报告或者EN149报告,项目没做齐全的话,需要重新做测试报告
4. 工厂图片、包装设计图、设备清单
5. 疫情期间预计的出货数量/日产能
注意:型号种不能有中文,标签要描述产品和销售的地方,比如医院等。
EUA认可标准和证书
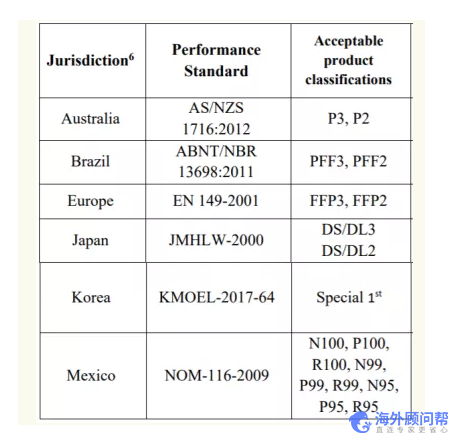
产品面向医用市场,满足以下标准或者认证即可:
- 欧盟CE 认证
- 澳大利亚ARTG
- 加拿大Health Canada Licence
- 日本PMDA/ MHLW
未经任何NIOSH认证的中国制造防护口罩只要满足以下三个条件之一即可向FDA申请紧急批准(EUA)。
- 工厂生产的其他型号过了NIOSH官方认证(列如拿到了N95认证)
- 满足其他国家的市场注入并客厅FDA验证
- 有资质的第三方检测报告能够证明产品满足相关标准,并可以提供证明给FDA验证(根据中国的相关标准进行设计和验证的产品)。
以下相关标准:
EUA批准只是应急方案,疫情结束后需要重新做NIOSH认证。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为海外产品认证提供一站式服务,咨询电话: 400-106-2206。















