医疗器械注册制度,自17年从上海诞生,便备受行业和社会的关注。实践证明,实行医疗器械注册对人们的身体健康做出了保证。本篇文章则主要介绍了医疗器械注册流程,还在等什么?快来看一看吧!
一、建立质量体系
按照《医疗器械注册管理办法》的要求,应当建立与产品研制、生产有关的质量管理体系,并保持有效运行。主要是对人、机、料、法、环五大环节进行控制,从而保证影响产品质量的因素可控而有效。
质量体系的框架结构是按照YY/T0287-2017的要求建立的,即包括质量手册、程序文件、管理文件、技术文件和相关的记录。其细节内容需要按照《医疗器械生产质量管理规范》(公告2014年第64号)的要求建立,特别要注意保持质量体系有效运行的证据即质量记录。
质量管理组织结构一般包含企业负责人、管理者代表、生产负责人、技术负责人、质量负责人、内审员、质检员、采购员、仓库管理员和行政管理人员等,其中生产、技术和质量管理人员应当具有与产品相关的专业知识,并具有相应的实践经验,熟悉医疗器械相关法规。
二、 研发工作
产品研发工作需要在质量管理体系的有效运作下进行,在进行设计和开发策划时,需要确定设计和开发的阶段及对各阶段的评审、验证、确认和设计转换等活动。至少包括以下内容:
- 设计和开发的各个阶段的划分;
- 适合于每个设计和开发阶段的评审、验证、确认和设计转换活动;
- 设计和开发各阶段人员和部门的职责、权限和沟通;
- 风险管理要求。
设计开发几个主要阶段
A. 设计开发策划
根据产品的特点,对设计开发活动进行策划,并将策划结果形成文件。至少包括以下内容:
- 设计和开发项目的目标和意义的描述,技术指标分析;
- 确定了设计和开发各阶段,以及适合于每个设计和开发阶段的评审、验证、确认和设计转换活动;
- 应当识别和确定各个部门设计和开发的活动和接口,明确各阶段的人员或组织的职责、评审人员的组成,以及各阶段预期的输出结果;
- 主要任务和阶段性任务的策划安排与整个项目的一致;
- 确定产品技术要求的制定、验证、确认和生产活动所需的测量装置;
- 风险管理活动。
应当按照策划实施设计和开发。当偏离计划而需要修改计划时,应当对计划重新评审和批准。
B. 设计开发转换
- 应当在设计和开发过程中开展设计转换活动以解决可生产性、部件及材料的可获得性、所需的生产设备、操作人员的培训等;
- 设计转换活动应当将产品的每一技术要求正确转化成与产品实现相关的具体过程或程序;
- 设计转换活动的记录应当表明设计和开发输出在成为最终产品规范前得到验证,并保留验证记录,以确保设计和开发的输出适于生产;
- 应当对特殊过程的转换进行确认,确保其结果适用于生产,并保留确认记录。
C. 设计开发需输出:
- 采购信息,如原材料、包装材料、组件和部件技术要求;
- 生产和服务所需的信息,如产品图纸(包括零部件图纸)、工艺配方、作业指导书、环境要求等;
- 产品技术要求;
- 产品检验规程或指导书;
- 规定产品的安全和正常使用所必须的产品特性,如产品使用说明书、包装和标签要求等。产品使用说明书是否与注册申报和批准的一致;
- 标识和可追溯性要求;
- 提交给注册审批部门的文件,如研究资料、产品技术要求、注册检验报告、临床评价资料、医疗器械安全有效基本要求清单等;
- 样机或样品;
- 生物学评价结果和记录,包括材料的主要性能要求。
三、 产品检验
试制出样品后,需要在有资质的的检验机构检验。
四、 临床评价
由于产品不属于免临床的产品需要进行临床试验或做同品种产品的比对,若是进行同品种产品比对,则需要获得同品种产品生产企业的授权,授权内容至少包括生产工艺和临床数据两方面的内容。按照《国家食品药品监督管理总局关于医疗器械临床试验备案有关事宜的公告(2015年第87号)》的要求向山东省食品药品管理局提出备案。
临床试验流程如下表
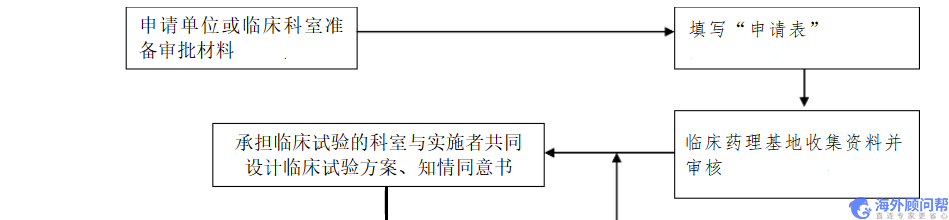
临床试验流程备注
1、厂家需提供产品详细说明
2、需提供诊断病症的详细介绍
3、确定编纂任务的时间/人员/分工
4、分派编纂计划的任务
5、收集计划并讨论修订
1、确定主要研究者/统计专家
2、讨论方案/CRF/知情同意书
3、明确各单位的费用组成/支付方式/费用额度
4、拟订各单位的协议初稿
5、资料报各单位研究者和基地审核
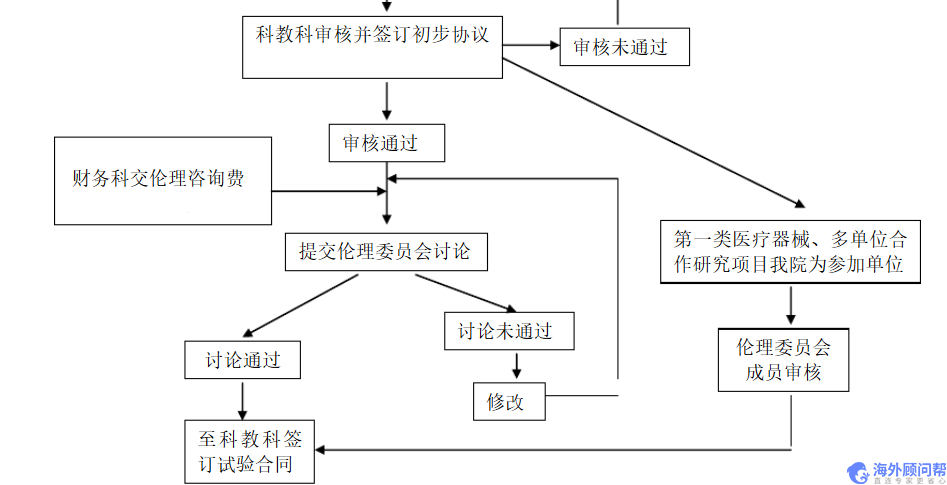
1、研究者手册,方案,CRF表,知情同意书报各独立伦理委员会
2、交纳伦理审评费用及上会
3、伦理审评会同意/修改后同意后批件与资料一起报基地备案
在试验项目经伦理审查通过并与临床试验机构签订协议或合同后,填写《医疗器械临床试验备案表》,提交备案表中列出的相关材料,向省食品药品监督管理局备案。
1、试验用品、研究费用准备
2、各单位检测项目的实验室正常值范围、操作规程、操作人员及其检测仪器型号记录表
3、临床监察计划表
4、研究费用支付收据或/及医院发票
5、启动会议,介绍临床情况及要求并做会议记录
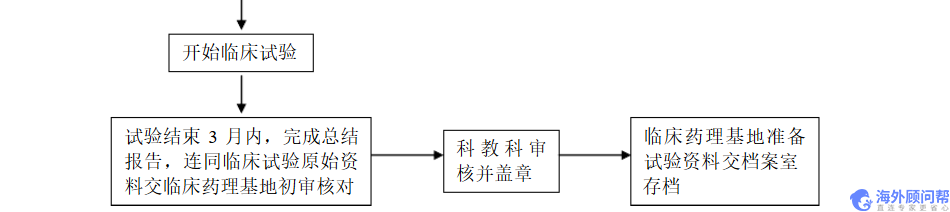
1、项目批件、质检报告、通讯录及临床监查资料
2、了解开始试验(入组)时间,说明监查时间,流程及内容
3、约见研究者,交流相关情况
4、监查结果通报研究者并解决遗留问题
1、统计数据录入
2、数据统计分析
3、出具统计分析分报告
4、出具统计分析总报告
5、与临床基地一起,出具临床分报告
6、全面复核病例报告表、知情同意书、统计人员完成电脑数据统计,并提供图、表表示
7、总结各单位(小组)进行的临床试验报告
1、撰写临床试验的质量及最终的临床试验总报告
2、递交临床管理单位审批
3、跟踪审批结果
1、结清余款
2、领取报告
3、试验器材撤场
4、向参与人员致谢等
备注:1、其中“伦理委员会审批”时间须视各临床基地近期伦理委员会召开的时间而定,临床基地将视接收的临床项目多少确定开会时间,一般情况下,3个月内将召开一次。
以上就是医疗器械注册流程的相关内容,了解更多请咨询【海外顾问帮】。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为医疗器械注册提供一站式服务,咨询电话: 400-106-2206。














